單級好氧和限氧污水處理系統中總氮損失的微生物學機理*
張 悅1 曾 薇1** 劉春蘭2 李 磊1 楊瑩瑩1 彭永臻1
(1北京工業大學環境與能源工程學院 北京 100124; 2杭州市財政性投資項目評審中心 杭州 310009)
摘 要 :近年來,單級好氧和限氧污水處理系統中總氮損失的現象引起了人們的普遍關注,本文對這種現象的微生物學機理及研究現狀進行了闡述,主要是幾類細菌的單獨脫氮或者它們之間的協同脫氮,包括自養(亞) 硝化菌單獨脫氮、好氧反硝化菌單獨脫氮、(亞)硝化菌和好氧反硝化菌的協同脫氮以及(亞)硝化菌和厭氧氨氧化菌的協同脫氮. 與傳統的硝化-反硝化脫氮工藝相比,這些脫氮新途徑具有不可比擬的優越性,對于強化污水生物脫氮具有重要意義. 圖8 參53
關鍵詞 :總氮損失;好氧反硝化;厭氧氨氧化;限氧
CLC X703
Microbiological Mechanism of Nitrogen Loss in Aerobic or Oxygen-limited Wastewater Treatment System*
(1College of Environmental and Energy Engineering, Beijing University of Technology, Beijing 100124, China) (2Evaluation Center of Hangzhou Government Investing Project, Hangzhou 310009, China)
Abstract In recent years, the phenomenon of total nitrogen loss which is found in single aerobic or oxygen-limited wastewater treatment systems has attracted researchers’ concern. Microbiological theory and related studies of nitrogen loss were reviewed in this paper. It involves the different groups of bacteria alone or in cooperation, including nitrogen removal by autotrophic nitrifying bacteria and aerobic denitrifying bacteria, the inter-synthesis between nitrifying bacteria and aerobic denitrifying bacteria; and the cooperation of nitrifying bacteria and anaerobic ammonia oxidation (Anammox) bacteria. The new biological nitrogen removal mechanisms, which have incomparable advantages to the traditional nitrification-denitrification nitrogen removal technique, have important significance to enhance nitrogen removal in wastewater treatment. Fig 8, Ref 53
Keywords nitrogen loss; aerobic denitrification; anaerobic ammonia oxidation (Anammox); oxygen-limited
CLC X703
傳統生物脫氮理論認為生物脫氮包括硝化和反硝化兩個階段,相應的功能微生物分別是硝化細菌和反硝化細菌. 硝化細菌通常是自養型好氧微生物,主要由亞硝化菌和硝化菌兩類構成,分別從NH3-N和NO2-N的氧化過程中獲得能量,需要O2 作為呼吸的最終電子受體;反硝化細菌大都是異養型兼性厭氧菌,在厭氧條件下從有機物的氧化過程中獲取能量,將NO3-N (或NO2-N)作為無氧呼吸時的電子受體. 由于硝化細菌和反硝化細菌各自適宜的生長條件不同,現行的生物脫氮工藝幾乎都是將硝化和反硝化過程獨立運行[1],如代表性的Bardenpho、A/O、A2O、UCT、雙溝式氧化溝工藝(從空間上分開)和SBR工藝(從時間上分開). 但是,近十余年來,在很多單級好氧或限氧的污水處理系統中都發現了總氮損失現象[2~5],總氮損失率高達30%~51%,這一現象有悖于傳統脫氮理論,其微生物學機理已成為研究熱點。
所謂“單級污水處理系統中的總氮損失”,就是通過脫氮微生物的協同作用,在同一空間、同一時間內完成氨氮(NH3-N)等化合態氮向氮氣或氣態氮氧化物轉化的過程,由此,不僅氨氮得到去除,而且水處理系統中總氮濃度明顯降低. 目前,從物理學角度以“微環境理論”解釋這種現象已被普遍接受. 該理論認為,在單級系統中由于活性污泥絮體或者生物膜中的氧的濃度梯度使得硝化和反硝化同時進行. 近年來,關于脫氮微生物種類和代謝途徑多樣性的研究有了很大進展,發現了幾種新的脫氮途徑和功能微生物,這不僅為單級系統中總氮損失現象提供了更加合理的解釋,而且也為進一步探索新的生物脫氮技術奠定了理論基礎. 本文在傳統脫氮理論的基礎上,結合當前國內外研究現狀,對引起單級污水處理系統中總氮損失的功能微生物及其微生物學機制進行闡述。
1 自養(亞)硝化菌脫氮
化作用下將NH3-N轉化為NH2OH,然后在羥氨氧化酶(HAO)的催化作用下將NH2OH氧化為NO2-N (式①、②);硝化菌在亞硝酸氧化酶(NOR)的催化作用下將NO2-N氧化為NO3-N(式③).
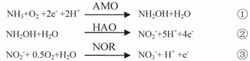
上述傳統脫氮理論在自然界氮物質循環中發揮著重要的作用. 傳統理論認為,無論是亞硝化菌還是硝化菌都不能單獨將NH3-N轉化為N2或氣態氮氧化物. 但隨著研究的不斷深入,發現了某些(亞)硝化菌具有不同于傳統脫氮理論的其
他脫氮途徑,從而為污水生物脫氮的強化開辟了新途徑.
1.1 自養(亞)硝化菌的反硝化脫氮
研究表明,某些亞硝化菌和硝化菌具有部分或者全部的反硝化功能. 在相關研究中對亞硝化菌具有反硝化功能的報道相對多一些,但不排除某些硝化菌也具有反硝化功能. 早在1972年就有研究報道,在微藻類條件下某些自養硝化菌可以在好氧或厭氧條件下還原亞硝酸鹽產生N O [6]. Bock等分別在1988和1995年先后證實了硝化細菌中的亞硝化單胞菌屬(Nitrosomonas)和硝化桿菌屬(Nitrobacter)在厭氧條件下具有反硝化能力[7, 8]. 近年有研究表明Nitrosomonas菌屬中的N. europaea [9]和N. eutropha [10]具有反硝化能力,能夠在低氧量的狀態下氧化NH -N產生N O、NO或N . Wrage等的研究同樣表明,NH -N被氧化為NO -N后可以被自養亞硝化菌的還原酶系還原生成N O和N ,整個過程由自養菌完成[11].
Wrage [11]、Shrestha [12]等先后對亞硝化菌的硝化–反硝化脫氮的代謝途徑進行研究,認為亞硝化菌的硝化–反硝化過程是在一系列氧化酶系(硝化過程)和還原酶系(反硝化過程)的催化作用下分別進行的,這和傳統硝化–反硝化理論相似,不同的是整個過程由亞硝化菌單獨完成. 其總結的代謝途徑如圖1所示.
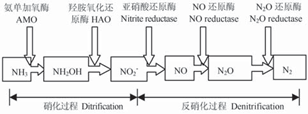
圖1 亞硝化菌的硝化–反硝化代謝途徑[11, 12]
Fig. 1 Nitrification and denitrification carried out by ammonia-oxidizing bacteria [11, 12]
與上述理論不同,有研究者將自養(亞)硝化菌的單獨脫氮歸結為硝化–反硝化的耦合作用(圖2) [10, 14],即認為硝化過程和反硝化過程相互依賴于微生物體內的NADH呼吸鏈. Naqvi采用氮的同位素示蹤法研究阿拉伯海域內N2O的產生機理,觀察到當硝化反應和反硝化反應分別發生時沒有產生被標記的N2O,因此得出同樣結論,即N2O很有可能是由某些硝化菌的硝化–反硝化耦合作用產生的[13].
相對于傳統反硝化來說,自養(亞)硝化菌的反硝化效率非常低. Ralf等的試驗證明,在高氨溶液[氨氮濃度700 mg (N)L-1]中單獨培養的Nitrosomonas將NH -N轉化為NO -N后,僅能將0.28%的NO -N還原[15];Tallec的研究表明,當DO濃度為 0.4~1.1 mg (O2)/L時,由某些硝化菌反硝化產生的N2O占總N2O 產量的60%,N O總量占NO -N損失的0.4% [16];Wrage認為由硝化菌反硝化產生的N O僅占總N O產量的30% [11]. 另有研究者對亞硝化系統的研究結果表明,自養亞硝酸菌能將總氮的0.2%轉化為NO,1.7%轉化為N O [17].
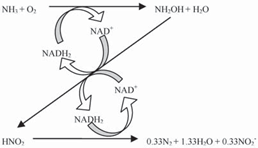
2 自養硝化菌脫氮的假設途徑[10, 14]
Fig. 2 Hypothetical model of autotrophic nitrifying bacteria [10, 14]
Schmidt等對硝化過程中釋放NO等氮氧化物的現象進行了大量研究,揭示此現象是基于亞硝化菌中Nitrosomonas 類細菌的作用,提出缺氧條件下的NO 循環模型(圖3) [18]. NO 和NO2 之間不斷循環轉化,在缺氧條件下活性更強的NO2代替O2作為電子受體,從而實現AMO對NH3-N的氧化過程.
現在已經確認的是N. eutropha、N. europaea和Nitrosolobusmultiformis都能進行上述反應途徑. Schmidt等將其反應方程式歸納為:
NH +N O +H++2e- → NH OH+2NO+H O
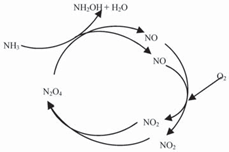
圖3 NO 循環作用下Nitrosomonas類細菌的缺氧氨氧化假設模型[18]
Fig. 3 Hypothetical model of anoxic ammonia oxidation by Nitrosomonas-like bacteria [18]
對于反應式中N2O4 (NO2)的來源,有研究者認為,在限氧條件下,硝化單胞菌可在菌體內先形成NO,NO被溶解氧氧化為N2O4,然后在缺氧環境下NH3-N被N2O4氧化,終產物為NO、N O、N [19]. 也有研究者直接向反應系統內通入痕量的NO2 (N2O4)氣體來促進氨氮的去除. 李小鵬通過實驗也證明,在無分子氧情況下,亞硝化菌能發生基于NO2的氨氧化, 并且低濃度NO2 (體積分數<5×10 )條件下氨氧化速率較高, 總氮損失也較大[20].
2 好氧反硝化菌脫氮
多菌屬如產堿菌屬(Alcaligenes) [22]、克雷伯氏菌屬(Klebsiella) [23] 和假單胞菌屬(Pseudomonas) [24]都具有好氧反硝化功能. 好氧反硝化菌可以和硝化菌協同脫氮,某些好氧反硝化菌同時也是異養硝化菌,可以單獨脫氮.
2.1 好氧硝化菌和好氧反硝化菌的協同脫氮
好氧硝化菌和好氧反硝化菌的協同脫氮原理是:NH3-N首先由好氧硝化菌轉化為NO3-N (或NO2-N),然后好氧反硝化菌對NO3-N (或NO2-N)進行還原;其公認的還原途徑是: NO3-N分別由硝酸還原酶、亞硝酸還原酶、一氧化氮還原酶和一氧化二氮還原酶催化還原為N2.
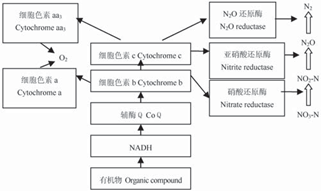
圖4 好氧反硝化菌反硝化過程的電子傳遞模型[26, 27]
Fig. 4 Schematic of branched respiratory electron transport chain of aerobic denitrifying bacteria [25, 26]
早期理論認為,O2 的存在對反硝化過程有抑制作用, 主要表現在O2 相對NO3-N (或NO2-N)優先得電子,而且O2會氧化硝酸還原酶系使其失去催化活性. 后來Korner的研究表明,硝酸還原酶、亞硝酸還原酶和一氧化二氮還原酶對溶解氧的較大耐受濃度分別達到5.1、2.5和3.8 mg/L,說明在限氧條件下細菌的反硝化酶系依然有活性[25]. 目前關于好氧反硝化菌如何同時利用NO - (或NO -)和O 進行呼吸作用的微生物學代謝機制尚未得到一致的結論. 有研究者提出協同呼吸是好氧反硝化的作用機理,協同呼吸意味著氧和硝酸鹽同時作為電子受體,有機物提供的電子流同時傳輸給反硝化酶系統和氧,因此反硝化可以在好氧情況下發生[26, 27]. 這種好氧反硝化菌協同呼吸的電子傳遞途徑如圖4所示.
2.2 好氧反硝化細菌的單獨脫氮
好氧反硝化細菌的單獨脫氮是指某些好氧反硝化細菌同時也是異養硝化菌,其在好氧條件下可單獨作用將底物氨氮轉化為N2. 目前已報道兼具異養硝化功能的好氧反硝化菌有Pseudomonas stutzeri、Alcaligenes faecalis [28]、Comamonas sp. [29] 、 Thiosphaera pantotropha(Paracoccus denitrifications) [30]等. 研究者較早發現的既可以在好氧條件又可以在缺氧條件下生長的異養反硝化菌是T. pantotropha,并發現它有硝酸鹽還原酶,這種酶在有氧的情況下具有活性[31]. Wehrfritz等總結了T. pantotropha將異養硝化和好氧反硝化相結合的代謝模式(圖5) [32]:NH -N經T. pantotropha的AMO催化作用轉化為NH2OH,然后在HAO催化作用下將NH2OH氧化為NO2-N,利用氧化過程中產生的細胞色素c551作為反硝化酶系的電子供體,將NO2-N還原為含氮氣化物. 該研究還進一步說明從T.pantotropha中分離純化得到的HAO和N. europaea的HAO有顯著不同,且二者在羥氨氧化過程中的電子受體和電子傳遞途徑也是不同的.
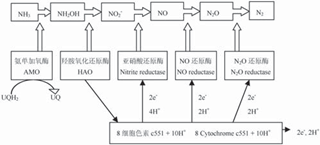
圖5 好氧反硝化細菌的單獨脫氮電子傳遞模式[32]
Fig. 5 Hypothetical model of ammonia removal by aerobic denitrifying bacterial [32]
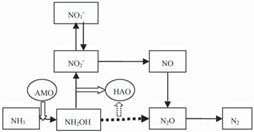
圖6 推測的好氧反硝化細菌的脫氮途徑[33]
Fig. 6 Hypothetical model of ammonia removal by aerobic denitrifying bacteria [33]
另有研究者推測的好氧反硝化菌可能存在的脫氮途徑[33]如圖6所示. 圖5和圖6的關鍵不同之處在于,圖6相對于圖5 多了一條氮的轉化途徑(如圖6虛線部分),即NH2OH可以在HAO的催化作用下不經過亞硝酸鹽而轉化為N2O,進而還原為N2. Rorberson很早(1988年)就證實了此結論,其研究表明在周圍環境有溶解氧的情況下,即使沒有中間產物亞硝酸鹽,T. pantotropha也能夠把氨轉換為氮氣. 較近Joo等研究了
Alcaligenes faecalis No.4的好氧硝化和好氧反硝化能力,發現硝化過程的主要產物是NH2OH,僅有很少的NH3-N轉化為 NO -N,因此推測其反硝化過程是通過NH OH完成的[34]. 何霞等對異養硝化細菌Bacillus sp. LY的研究也表明,其脫氮途徑很有可能如圖6虛線部分所示,并指出可能有一部分硝酸鹽或亞硝酸鹽生成羥胺,然后通過NH2OH→N2O→N2的方式脫氮[35].
Hippen等在1997年報道了一種適用于處理高濃度含氮廢水的新工藝[36]. 在該工藝中,氨轉化為氮氣的過程不需要按化學計量式消耗電子供體,這種特殊的轉化過程命名為“Aerobic deammonification”(好氧反氨化)工藝. 隨后又有研究者觀察到限氧條件下的總氮損失現象,后用熒光原位雜交技術(FISH)等分子生物學方法證明此現象是自養硝化菌和厭氧氨氧化菌協同脫氮的結果[37~39]. 較近有研究者用生物過濾器處理飲用水,在比正常需氧量低30%的條件下,硝化過程損失了1/3的NH -N,推測這同樣是基于上述脫氮機理[40].
自養亞硝化菌和厭氧氨氧化菌的脫氮機理如式④、⑤所示[41],在限氧條件下,NH -N被好氧亞硝化菌氧化成NO -N,消耗氧氣創造出缺氧環境(④式),隨后厭氧氨氧化菌在缺氧環境中將產生的NO2-N和剩余的NH3-N以及痕量的NO3-N轉化為N2 (⑤式):
NH +1.5O →NO -+H O+H+ ④
NH +1.32NO -+H+→1.02N +0.26NO -+ 2H O ⑤
NH +0.85 O →0.11NO -+0.44N +0.14H++1.43H O
Anammox (Anaerobic ammonia oxidation,厭氧氨氧化) 是上世紀90年代發現的一種新型生物脫氮途徑,由荷蘭學者Mulder在一小型流化床反硝化反應器中首次發現. 早在1977 年,奧地利理論化學家Broda就曾預言自然界存在以硝酸鹽或亞硝酸鹽為氧化劑的厭氧氨氧化反應. 目前已確定的厭氧氨氧化菌有3種,即Brocadia [42]、Kuenenia [43]和Scaliadua [44, 45], 其中,Brocadia包括B. anammoxidans和B. fulgida,Kuenenia包括K. stuttgartiensis,Scalindua包括S. wagneri、S. brodae和S. sorokinii. 研究者將厭氧氨氧化的可能代謝途徑歸納為圖7.
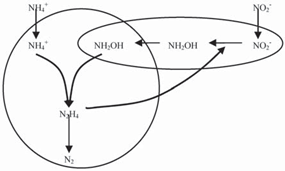
圖7 厭氧氨氧化的可能代謝途徑[16, 46]
Fig. 7 Hypothetical model of Anammox [16, 46]
厭氧氨氧化菌是專性厭氧菌,氧氣會抑制其活性. Strous 等研究發現,限氧環境(空氣飽和度<0.5%)對厭氧氨氧化菌的抑制是可逆的,被抑制后的厭氧氨氧化菌在厭氧狀態下可恢復活性[47]. Schimidt等指出厭氧氨氧化菌與亞硝化單胞菌能共同生存于限氧環境中[48]. Jetten等通過FISH證實了在限氧條件下亞硝化菌能與厭氧氨氧化菌穩定共存[49]. 這些發現為單一反應器內實現半亞硝化–厭氧氨氧化工藝奠定理論基礎.
通過15N示蹤試驗發現,厭氧氨氧化是以NO -而非NO -為電子受體[50]. 另有研究指出NO -也能用作厭氧氨氧化的電子受體[51],常規生物反硝化的兩種中間產物NO -和N O也能用作厭氧氨氧化的電子受體[52].
厭氧氨氧化的主要產物為N2,有研究者發現N2O4也是終產物[53]. 其原因如本文第1部分所述,缺氧環境中硝化過程產物可能為N2O、NO、NO2 (N2O4)、N2,所以硝化–厭氧氨氧化反應體系會導致多種氮的氣態產物產生.
4 總結與展望
4.1 關于污水生物脫氮系統中氮轉化機制的研究對于污水處理過程非常重要,本文綜述了好氧和限氧狀態下氮素損失的微生物學機理,為非傳統意義的總氮損失現象提供了生物學
方面的解釋. 實際生物脫氮過程涉及多種微生物的協同、耦合作用,由于生物處理工藝的復雜性,一些反應過程的機理還不是很明確,需要進一步研究. 總結了目前已知的單級系統脫氮形式,如圖8所示.
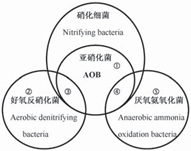
圖8 單級好氧或限氧系統內的微生物脫氮形式
Fig. 8 Pattern of nitrogen removal in aerobic or oxygen-limited system
①自養亞硝化菌單獨脫氮
①自養亞硝化菌單獨脫氮(底物: NH3-N);② 好氧反硝化菌單獨脫氮(底物: NH3-N);③自養(亞)硝化菌和好氧反硝化菌協同脫氮(底物: NH3-N);
④自養(亞)硝化菌和厭氧氨氧化菌協同脫氮(底物: NH3-N);⑤厭氧氨氧化(底物: NH3-N; NO2-N或NO3-N)
① Nitrogen removal by autotrophic nitrifying bacteria (Substrate: NH3-N);
② Nitrogen removal by aerobic denitrifying bacteria (Substrate: NH3-N);
③ Nitrogen removal by the cooperation of nitrifying bacteria and aerobic denitrifying bacteria (Substrate: NH3-N); ④ Nitrogen removal by the cooperation of nitrifying bacteria and Anammox bacteria (Substrate: NH3-N); ⑤ Anammox (Substrate: NH3-N; NO2-N or NO3-N)
4.2 基于傳統理論的硝化–反硝化脫氮依然是自然界的主要脫氮途徑,其脫氮貢獻率要遠遠高于 “自養(亞)硝化菌脫氮”、“好氧反硝化脫氮”、“自養亞硝化菌和厭氧氨氧化菌的協同脫氮”這些脫氮新途徑. 但是與傳統的硝化–反硝化脫氮技術相比,這些新途徑具有不可比擬的優越性,如可簡化工藝,節省設備費用,降低氧氣的供給,減少堿度消耗,減少甚至毋需碳源投加等等,因此關于這些脫氮新途徑的研究對于強化污水生物脫氮具有重要意義.
4.3 近年來在這些新的脫氮途徑研究的基礎上產生了多種新型生物脫氮工藝,如:依據亞硝化菌的限氧氨氧化理論, 比利時Gent大學微生物生態實驗室開發了OLAND (Oxygen limited autotrophic nitrification denitrfication)工藝;基于自養亞硝化菌和厭氧氨氧化菌的協同脫氮理論,2002年荷蘭Delft工業大學首先提出新型生物脫氮工藝—— CANON (Completely autotrophic nitrogen removal over nitrite)工藝,以及厭氧氨氧化菌脫氮的ANAMMOX工藝和SHARON-ANAMMOX聯合工藝. 如何將這些工藝大規模應用于工程實踐,還有待進一步研究探索.
4.4 N O可以導致地球臭氧防護層的明顯破壞,從而造成地球表層的不斷升溫,致溫效應約為CO2的310倍,是一種重要的溫室氣體. 本文中提到的某些氮素去除途徑中N2O可能作為硝化過程的副產物或者反硝化過程的產物而產生,所以在今后研究生物脫氮新途徑時,也要加強對N2O產生條件及機理的研究,進而研究其減量化,避免N2O的產生.
4.5 分子生物學技術是研究生物反應機理的有效實驗手段,可以為生化反應提供直接的證據. 近年來以FISH、PCR為代表的分子生物學技術已廣泛應用于污水生物處理系統的微生物學研究,在環境微生物的多樣性研究、特定微生物的原位分析以及微生物的功能研究方面取得了一定的成果. 迄今已有不少研究者將相關分子生物學技術應用于污水處理系統總氮損失的微生物學原理分析,可以預見,隨著分子生物技術進一步的發展與應用,人們對水處理系統中生物反應機理的認識將會更加深入透徹.
References
1 Kraume M, Bracklow U, Vocks M, Drews A. Nutrients removal in MBRs for municipal wastewater treatment. Wat Sci Tech, 2005, 51 (6~7): 391~402
2 Helmer C, Kunst S. Simultaneous nitrification/denitrification in an aerobic biofilm system. Wat Sci Tech, 1998, 37 (4~5): 183~187
3 Kuai L, Verstraete W. Ammonium removal by the oxygen-limited autotrophic nitrification-denitrification system. Appl Environ Microbiol, 1998, 64: 4500~4506
4 Koch G, Siegrist H. Mathematical modeling of autotrophic denitrification in a nitrifying biofilm of a rotating biological contracter. Wat Sci Tech, 2000, 41: 191
5 Sun GZ, Austin D. Completely autotrophic nitrogen-removal over nitrite in lab-scale constructed wetlands: Evidence from a mass balance study. Chemosphere, 2007, 68 (6): 1120~1128
6 Bitchie GAF, Nicholas DJD. Identification of the sources of nitrogen oxide produced by oxiydative and reductive processes in N. europeae. Biochem J, 1972, 126: 1181~1191
7 Bock E, Wilderer PA, Freitag A. Growth of nitrobacter in the absence of dissolved oxygen. Water Res, 1988, 22 (2): 245~250
8 Bock E, Schmidt I, Stuven R, Zart D. Nitrogen loss caused by denitrifying Nitrosomonas eutropha cells using ammonium or hydrogen as electron donors and nitrite as electron acceptor. Arch Microbiol , 1995, 163: 16~20
9 Shrestha NK, Hadano S, Kamachi T, Okura I. Dinitrogen production from ammonia by Nitrosomonas europaea. Appl Catal A Gen, 2002, 237 (1): 33~39
10 Ahn Y. Sustainable nitrogen elimination biotechnologies: A review.Process Biochem, 2006, 41 (8): 1709~1721
11 Wrage N, Velthof GL, van Beusichem ML, Oenema O. Role of nitrifier denitrification in the production of nitrous oxide. Soil Biol Biochem, 2001, 33 (12~13): 1723~1732
12 Shrestha NK, Hadano S, Kamachi T, Okura I. Dinitrogen production from ammonia by Nitrosomonas europaea. Appl Catal A Gen, 2002, 237 (1~2): 33~39
13 Naqvi SWA, Noronha RJ. Nitrous oxide in the Arabian Sea. Deep Sea Res A Oceanogr Res Papers, 1991, 38 (7): 871~890
14 Wang JL (王建龍). 生物脫氮新工藝及其技術原理. China Water &Wastewater (中國給水排水), 2000, 16 (4): 25~28
15 Stuven R, Bock E. Nitrification and denitrification as source for NO and NO2 production in high-strength wastewater. Water Res, 2001, 35 (8): 1905~1914
16 Tallec G, Garnier J, Billen G, Gousailles M. Nitrous oxide emissions from denitrifying activated sludge of urban wastewater treatment plants,under anoxia and low oxygenation. Bioresour Technol, 2008, 99 (7): 2200~2209
17 Kampschreur MJ, van der Star WRL, Wielders HA, Mulder JW, Jetten MSM, van Loosdrecht MCM. Dynamics of nitric oxide and nitrous oxide emission during full-scale reject water treatment. Water Res, 2008, 3 (42): 812~826
18 Schmidt I, Hermelink C, van de Pas-Schoonen K, Strous M, den Camp HJO, Kuenen JG, Jetten MSM. Anaerobic ammonia oxidation in the presence of nitrogen oxides (NOx) by two different lithotrophs. Appl Environ Microbiol, 2002, 68 (11): 5351~5357
19 Zart D, Bock E. High rate of aerobic nitrification and denitrification by Nitrosomonas eutropha grown in a fermentor with complete biomass retention in the presence of gaseous NO2 or NO. Arch Microbiol, 1998,169: 282~286
20 Li XP ( 李小鵬). Study on the mechanisms of NO2 enhancing ammonium oxidation: [Master’s Degree Dissertation]. Chongqing, China (重慶): Chongqing University (重慶大學), 2004
21 Robertson LA, Kuenen JG. Aerobic denitrification: A controversy revived. Arch Microbiol, 1984, 139: 351~354
22 Patureau D, Zumstein E, Delgenes JP, Moletta R. Aerobic denitrification isolation from diverse natural and managed ecosystems. Microb Ecol, 2000, 39: 145~152
23 Kim YJ, Yoshizawa M, Takenaka S, Murakami S, Aoki K. Isolation and culture conditions of a Klebsiella pneumoniae strain that can utilize ammonium and nitrate ions simultaneously with controlled iron and molybdate ion concentrations. Biosci Biotechnol Biochem, 2002, 66 (5): 996~1001
24 Takaya N, Maria Antonina BCS, Yasushi S, Isao K, Zhou ZM, Hirofumi Sl. Aerobic denitrification bacteria that produce low levels of nitrous oxide. Appl Environ Microbiol, 2003, 69 (6): 3152~3157
25 Korner H, Zumft WG. Expression of denitrification enzymes in response to the dissolved oxygen level and respiratory substrate in continuous culture of Pseudomonas stutzeri. Appl Environ Microbiol, 1989, 55: 1670~1676
26 Lloyd D. Aerobic denitrification in soils and sediments: from fallacies to facts. Trends Ecol Evol, 1993, 8: 352~356
27 Wilson LP, Bouwer EJ. Biodegradation of aromatic compounds under mixed oxygen/ denitrifying conditions: A review. J Ind Microbiol Biotechnol, 1997, 18: 116~130
28 Joo HS, Hirai M, Shoda M. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification by Alcaligenes faecalis No. 4. J Biosci Bioeng, 2005, 100 (2): 184~191
29 Patureau D, Bernet N, Moletta R. Combined nitrification and denitrification in a single aerated reactor using the aerobic denitrifier Commonas sp. strain SGLY2. Water Res, 1997, 31 (6): 1363~1370
30 Gupta SK, Kshirsagar M. Quantitative estimation of Thiosphaera pantotropha from aerobic mixed culture. Water Res, 2000, 34 (15): 3765~3768
31 Bell LC, Ferguson SJ. Nitric and nitrous oxide reductase are active under aerobic conditions in cells of Thiosphaera pantotropha. J
32 Biochem, 1991, 273: 423~427 32 Wehrfritz JM, Reilly A, Spiro S, Richarson DJ. Purification of hydroxylamine oxidase from Thiosphaera pantotropha: Identi? cation of electron acceptors that couple heterotrophic nitri? cation to aerobic denitri? cation. FEBS Lett, 1993, 335: 246~250 33 Richardson DJ, Wehrfritz JM, Keech A, Crossman LC, Roldan MD, Sears HJ, Butler CS, Reilly A, Moir JWB, Berks BC, Ferguson SJ, Thomson AJ, Spiro S. The diversity of redox proteins involved in bacterial heterotrophic nitri? cation and aerobic denitri? cation. Biochem Soc Trans, 1998, 26 (3): 401~408 34 Joo HS, Hirai M, Shoda M. Improvement in ammonium removal efficiency in wastewater treatment by mixed culture of Alcaligenes faecalis No.4 and L1. J Biosci Bioeng, 2007, 103 (1): 66~73 35 He X (何霞), Lü J (呂劍), He YL (何義亮), Zhao B (趙彬), Li CJ (李 春杰). Study progress on the mechanism of heterotrophic nitri? cation. Acta Microbiol Sin (微生物學報), 2006, 46 (5): 844~847 36 Hippen A, Rosenwinkel K, Baumgarten G, Seyfried CF. Aerobic deammoni? cation: A new experience in the treatment of wastewaters. Wat Sci Tech, 1997, 35 (10): 111~120 37 Third KA, Sliekers AO, Kuenen JG, Jetten MSM. The CANON system (Completely autotrophic nitrogen-removal over nitrite) under ammonium limitation: Interaction and competition between three groups of bacteria. Syst Appl Microbiol, 2001, 24 (4): 588~596 38 Gaul T, Filipov E, Schlosser N, Kunst S, Helmer-Madhok C. Balancing of nitrogen conversion in deammonifying bio? lms through batch tests and GC/MS. Wat Sci Tech, 2002, 46 (4, 5): 157~162 39 Pynaert K, Smets BF, Wyffels S, Beheydt D, Siciliano SD, Verstraete W. Characterization of an autotrophic nitrogen-removing bio? lm from a highly loaded lab-scale rotating biological contactor. Appl Environ Microbiol, 2003, 69: 3626~3635 40 Yu X, Qi ZH, Zhang XJ, Yu P, Liu B, Zhang LM, Fu L. Nitrogen loss and oxygen paradox in full-scale biofiltration for drinking water treatment. Water Res, 2007, 41 (7): 1455~1464 41 Kuenen JG, Jetten MSM. Extraordinary anaerobic ammonium-oxidizing bacteria. ASM News, 2001, 67 (9): 456~463 42 Kartal B, van Niftrik L, Sliekers O, Schmid MC, Schmidt I, van de PasSchoonen K, Cirpus I, van de Star W, van Loosdrecht M, Abma W, Kuenen JG, Mulder JW, Jetten MSM, den Camp HO, Strous M, van de Vossenberg J. Application eco-physiology and biodiversity of anaerobic ammonium-oxidizing bacteria. Rev Environ Sci Biotechnol, 2004, 3: 255~263 43 Egli K, Franger U, Alvarez PJJ, Siegrist H, van der Meer JR, Zehnder
33 AJB. Enrichment and characterization of ananmmox bacterium from a rotating biological contractor treating ammonium-rich leachate. Arch Microbiol, 2001, 175: 198~207 44 Kuypers MMM, Sliekers AO, Lavik G, Schmid M, Jorgensen BB, Kuenen JG, Sinninghe Damsté JS, Strous M, Jetten MSM. Anaerobic ammonium oxidation by anammox bacteria in the Black Sea. Nature, 2003, 422: 608~611 45 Schmid M, Walsh K, Webb R, Rijpstra WIC, van de Pas-Schoonen K, Verbruggen MJ. Candidatus “Scalindua brodae”, sp. nov., Candidatus “Scalindua wagneri”, sp. nov., two new species of anaerobic ammonium oxidizing bacteria. Syst Appl Microbiol, 2003, 26: 529~538
34 46 Van de Graaf AA, Mulder A, de Bruijn P, Jetten MS, Robertson LA, Kuenen JG. Anaerobic oxidation of ammonium is a biologically mediated process. Appl Environ Microbiol, 1995, 61: 1246~1251 47 Strous M, Heijnen JJ, Kuenen JG, Jetten MSM. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium oxidizing microorganisms. Appl Microbiol Biotechnol, 1998, 50 (5): 589~596 48 Schmidt I, Sliekers O, Schmidt M, Cirpus I, Strous M. Aerobic and anaerobic ammonia oxidizing bacteria-competitors or natural partners. Microbiol Ecol, 2002, 39: 175~181 49 Jetten MSM, Sliekers O, Kuypers M, Dalsgaard T, van Niftrik L, Cirpus I, van de Pas-Schoonen K, Lavik G, Thamdrup B, Paslier De, Op den Camp HJM,
蘇州湛清環保科技有限公司
熱線:400-110-8500
傳真:0512-50310052
郵箱:sales@drtsing.com
地址:江蘇省蘇州市昆山玉帶西路樂邦產業園